Nuestra investigación se centra en el diseño y desarrollo de nuevos fármacos, y herramientas farmacológicas, dirigidos al tratamiento y diagnóstico de enfermedades neurodegenerativas y cáncer. Empleamos modernas metodologías de síntesis orgánica, así como herramientas y conceptos innovadores propios de la investigación en química médica, para su posterior aplicación en medicina.
Nuestro grupo trabaja en el desarrollo de nuevos radiotrazadores selectivos para el diagnóstico in vivo de taoupatías mediante tomografía de emisión de positrones 18F-PET. Las tauopatías son enfermedades neurodegenerativas caracterizadas por la acumulación de proteína tau en las neuronas. La más popular es la enfermedad de Alzheimer (EA), aunque existen otras tauopatías como la enfermedad de Pick y la parálisis supranuclear progresiva. En la actualidad, el diagnóstico de la EA sólo se puede confirmar mediante análisis postmortem tras autopsia. Existe, por tanto, la necesidad de investigar y desarrollar nuevas metodologías de diagnóstico temprano de la EA, que contribuyan a una mayor eficacia en el desarrollo de nuevos fármacos moduladores de la enfermedad.
EA a nivel patológico se caracteriza, principalmente, por la presencia de dos agregados diferentes de tipo proteico en el cerebro: β-amiloide, cuya acumulación forma las llamadas placas seniles (SP) en el medio extracelular y tau hiperfosforilada, depositada intracelularmente en forma de ovillos neurofibrilares (NFT). Debido a la coexistencia tanto de SP como NFT en el cerebro de pacientes con EA, ambos pueden ser considerados biomarcadores de la enfermedad. La función de la proteína tau, una vez fosforilada, es el ensamblaje y estabilización de los microtúbulos, unos filamentos que tienen una función estructural, y que en neuronas están específicamente relacionadas con las ramificaciones dendríticas. Cuando tau se hiperfosforila, comienza un proceso de agregación que da lugar a unos filamentos helicoidales insolubles (NFT), perdiendo su función estabilizadora de los microtúbulos. Esta desestabilización provoca finalmente la muerte neuronal y por tanto, la interrupción de la sinapsis con la consecuente pérdida de memoria en los pacientes.
Actualmente, los radiotrazadores PET más desarrollados son los correspondientes a β-amiloide. Algunos de estos radiotrazadores desarrollados para SPs, han mostrado también cierta capacidad para la detección de NFTs, pero su especificidad diferencial entre SPs y NFTs es baja. Por otro lado, estudios recientes apuntan a que la acumulación de tau está relacionada con la aparición de los primeros síntomas de la EA y que la densidad de los ovillos neurofibrilares está asociada con el avance de la enfermedad, al contrario que ocurre con β-amiloide. Además, la aparición de NFT en zonas diferentes y específicas del cerebro es un indicador del grado de avance en EA. Este hecho permite diferenciar entre las diferentes tauopatías. Por ello, en los últimos años, tau se ha convertido en un objetivo terapéutico importante para la detección de EA.
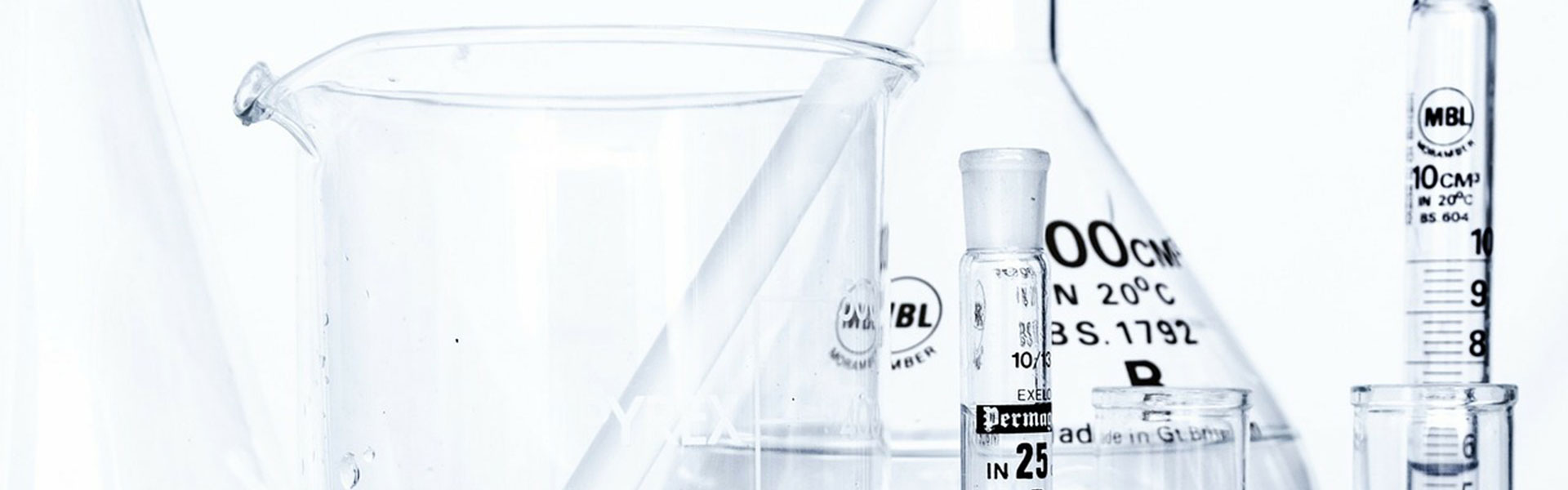
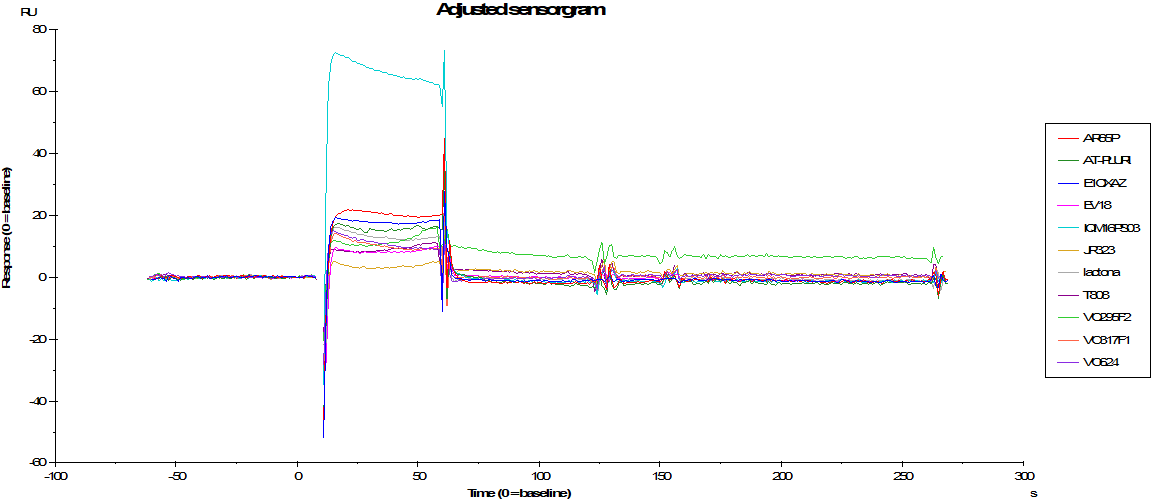
Nuestra estrategia se basa, por tanto, en la síntesis de nuevos compuestos de naturaleza heterocíclica, con una afinidad selectiva hacia los agregados de tau. Para ello diseñamos y sintetizamos las nuevas estructuras químicas y las evaluamos frente a los agregados de tau mediante estudios de SPR, estudios biológicos in vitro y RMN, seleccionando aquellos compuestos con las mejores afinidades. Posteriormente llevamos a cabo la radiosíntesis de los correspondientes productos marcados con 18F y evaluamos in vivo su potencial como radiotrazadores mediante tomografía de emisión de positrones (18F-PET). Adicionalmente realizamos la evaluación farmacológica de estos compuestos, incluyendo ensayos de afinidad y selectividad in vivo por los NFTs, estudios de lipofilia, toxicidad y metabolismo.
Por otro lado, estamos interesados en el descubrimiento de fármacos que actúen de manera selectiva sobre las células madre tumorales (CSC) con el fin de desarrollar nuevas herramientas terapéuticas frente a cáncer de mama y gliomas, principalmente.
La enorme variabilidad intra e intertumoral existente es la principal causa del fracaso terapéutico y pone en evidencia la ausencia de terapias antitumorales específicas para cada tipo y subtipo de enfermedad oncológica. La heterogeneidad fenotípica y funcional existente entre los diferentes cánceres se da no sólo a nivel de tumores procedentes de diversos tejidos, sino que se produce incluso entre aquellos que provienen del mismo órgano (heterogeneidad intertumoral). El sorprendente escenario de la heterogeneidad tumoral se complica enormemente al ponerse de manifiesto que estas variaciones también tienen lugar dentro de un mismo tumor (heterogeneidad intratumoral). Numerosos trabajos de investigación de los últimos años han demostrado una clara relación entre las vías que controlan la capacidad de autorrenovación de las células tumorales y la propia etiologia de la enfermedad oncológica.
En la actualidad, el modelo de las Células Iniciadoras de Tumores, ó Cancer Stem Cells (CSC), es el principal modelo existente para explicar cómo se originan, mantienen y expanden los tumores, así como sus mecanismos para evadir los tratamientos dando lugar a recidivas o metástasis. Este modelo postula que únicamente una subpoblación celular, con las características de autorrenovación y diferenciación atribuidas a células madre, sería capaz de generar y mantener el tumor.
La presencia de CSC en la mayoría de los principales tipos de cáncer parece ser una de las principales causas del fracaso de las terapias oncológicas actuales tanto a nivel de prevención de la progresión tumoral como en la aparición de recidivas, por lo que la eliminación de esta subpoblación mediante el empleo de fármacos que actúen selectiva y eficazmente sobre la misma, supone un paso esencial para la obtención de una cura eficaz.
Adicionalmente, numerosos trabajos de investigación han demostrado la existencia de una clara relación entre los diversos factores de transcripción que se activan ante la hipoxia tisular y las vías que controlan la capacidad de autorrenovación de las células, sugiriendo así un papel esencial del Factor Inducible por Hipoxia (Hypoxia Inducible Factor, HIF) en la oncogénesis a través de la generación o expansión de las CSC. Por lo tanto, la biología de las proteínas HIF ha evolucionado en la última década desde su papel en la angiogénesis del tumor, hasta la misma etiología de la enfermedad oncológica.
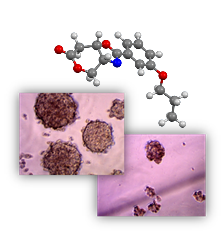
La estrategia de nuestro grupo de investigación se enfoca en las síntesis de compuestos no tóxicos que inhiben la actividad de HIF y SOX-2 interfiriendo con la formación de oncoesferas, células tumorales que en condiciones de cultivo pierden la adhesión formando esferas tridimensionales que están admitidas como CSC capaces de iniciar los tumores en modelos animales de enfermedad oncológica. El factor de transcripción SOX-2, regulado por HIF2α, es un marcador embrionario que se asocia a las formas más indiferenciadas del cáncer de mama y de gliomas, siendo a su vez el responsable funcional de la formación de oncoesferas en los cultivos in vitro de líneas celulares tumorales.